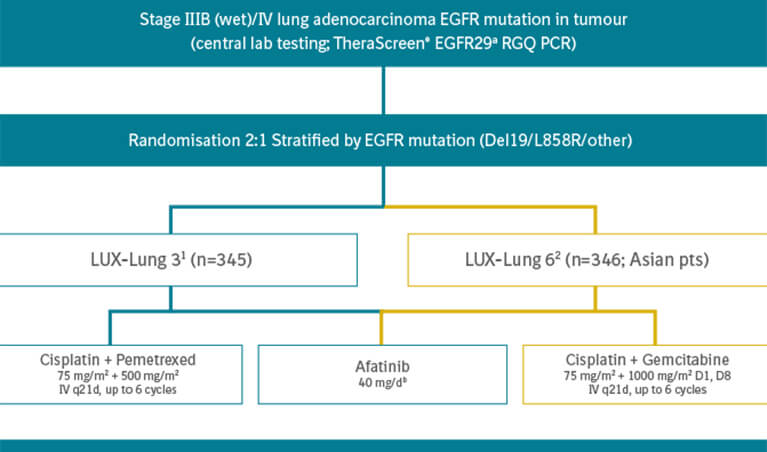
GIOTRIF®:
Pilihan pertama pada lini pertama
Efektivitas superior vs gefitinib dan vs kemoterapi yang ditunjukkan oleh 3 penelitian besar pada pengobatan lini pertama KPKBSK EGFR M+1-4
Kejadian Tidak Diinginkan (KTD) pada penggunaan Giotrif®
01/05/2019
Author: Boehringer Ingelheim
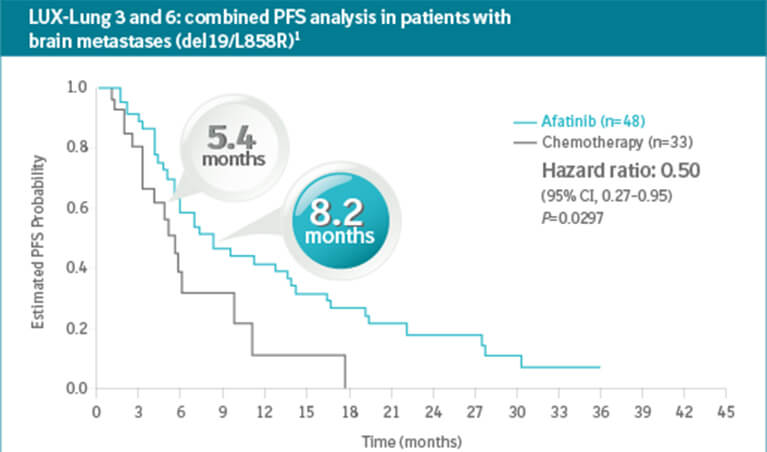
Kejadian Tidak Diinginkan (KTD) pada penggunaan Giotrif® dapat diprediksi dan diatasi dengan baik. KTD ini telah terdokumentasi pada 3 pivotal studi utama: LUX-LUNG 3, 6, dan 7.
- Kejadian Tidak Diinginkan Serius (>Grade 3) konsisten pada angka 5-14%
- Discontinuation rate konsisten pada angka 6-8%
• LUX LUNG 7 menunjukan data yang sama untuk Giotrif® maupun gefitinib
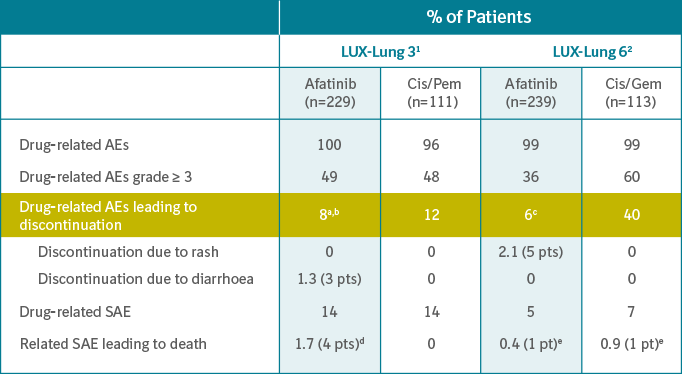
aIncludes 3 patients (1%) who discontinued due to diarrhoea, no discontinuations for rash.
bIncludes 3 patients (1%) with ILD-like events (1 grade 1,1 grade 3; 1 grade 5).
cIncluding 1 patient with ILD.
dPreferred terms:dyspnoea, sepsis, ARDS, death (unknown cause).
eSudden death (afatinib) and cardiac failure (Cis/Gem).
SAE = serious adverse event; ILD = interstitial lung disease; ARDS = acute respiratory disuess syndrome.
bIncludes 3 patients (1%) with ILD-like events (1 grade 1,1 grade 3; 1 grade 5).
cIncluding 1 patient with ILD.
dPreferred terms:dyspnoea, sepsis, ARDS, death (unknown cause).
eSudden death (afatinib) and cardiac failure (Cis/Gem).
SAE = serious adverse event; ILD = interstitial lung disease; ARDS = acute respiratory disuess syndrome.
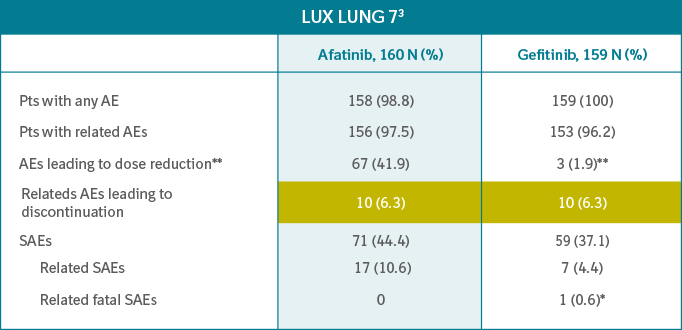
*hepatic failure (reported as DILI case)
**Dose modification for afatinib according to label.
Dose modification for gefitinib is not described in the label
**Dose modification for afatinib according to label.
Dose modification for gefitinib is not described in the label
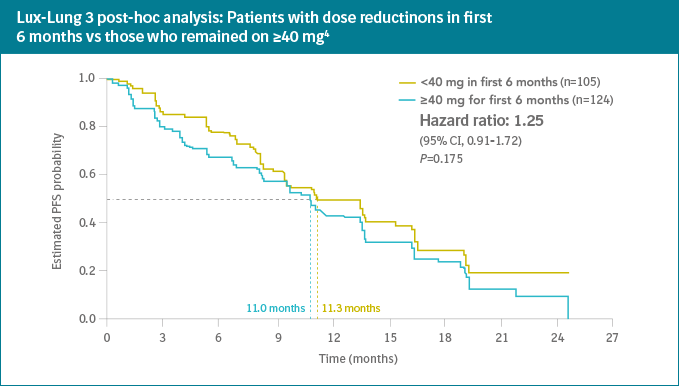
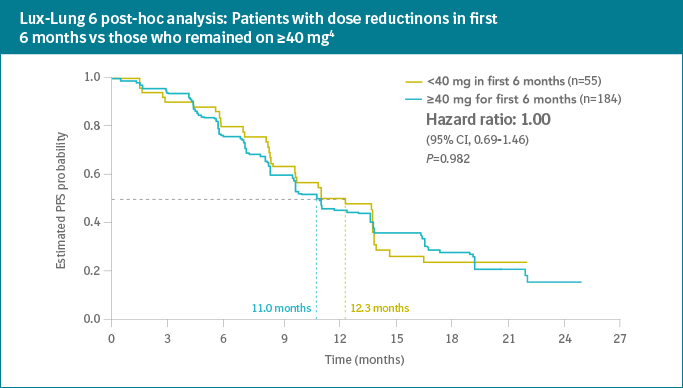
- Penurunan dosis tidak mempengaruhi efikasi terapi
- Rekomendasi penurunan dosis patut diberikan untuk pasien-pasien dengan:
• AE Grade 2 berkepanjangan dan tidak dapat ditoleransi
• AE > Grade 3 - Rekomendasi manajemen AE diatas adalah menghentikan terapi sementara (paling lama hingga 14 hari), atau menunggu hingga grade 0/1 dan melanjutkan kembali pemberian Giotrif® dengan dosis 10 mg lebih rendah
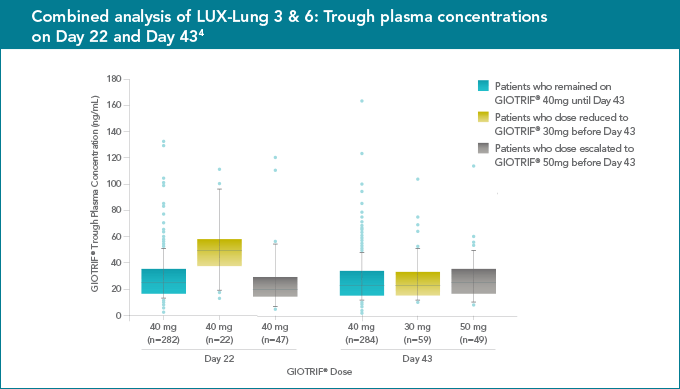
- Analisis plasma menunjukan konsentrasi afatinib yang berbeda-beda pada setiap individual yang mengharuskan penanganan perorangan dalam terapi
Konten terkait
Referensi & Catatan Kaki:
1. Sequist LV, et al. J Clin Oncol 2013;31(27):3327-3334.
2. Wu Y, et al. Lancet Oncol 2014;15(2):213-222.
3. Park K, et al. Lancet Oncol 2016;17(5):577-589.
4. Yang JCH et al. Ann Oncol 2016;27(11):2103-2110.
MPR-ID-100006
Production date: May 2019
Production date: May 2019
Apa itu Afatinib (Giotrif®)?
Afatinib (Giotrif®) merupakan suatu pemblokir kelompok ErbB yang bersifat irreversibel dan telah disetujui di lebih dari 70 negara. Obat ini diindikasikan sebagai pengobatan pasien dewasa dengan Epidermal Growth Factor Receptor (EGFR) mutasi positif kanker paru jenis karsinoma bukan sel kecil (KPKBSK) pada exon 19 deletions atau exon 21 mutasi substitusi, yang berada pada tahap lanjut baik bersifat lokal atau metastasis yang belum pernah mendapatkan EGFR TKI (Epidermal Growth Factor Receptor Tyrosin Kinase Inhibitor); dan juga sebagai pengobatan untuk pasien KPKBSK dengan histologi skuamosa yang berada pada tahap lanjut baik bersifat lokal atau metastasis, yang progresif selama atau setelah kemoterapi berbasis platinum. Pengobatan ini merupakan terapi oral, sekali sehari, dan merupakan suatu terapi target.1
*Afatinib telah disetujui di lebih dari 70 negara termasuk Eropa, Jepang, Taiwan, dan Kanada yang dikenal dengan merek Giotrif®, sedangkan di AS dikenal dengan nama Giotrif® dan di India dikenal dengan Xovoltib®
*Afatinib telah disetujui di lebih dari 70 negara termasuk Eropa, Jepang, Taiwan, dan Kanada yang dikenal dengan merek Giotrif®, sedangkan di AS dikenal dengan nama Giotrif® dan di India dikenal dengan Xovoltib®
INFORMASI PROFIL KEAMANAN PENTING
Informasi terpenting apakah yang harus saya ketahui tentang Afatinib (Giotrif®)?
Efek samping dari Afatinib dapat terprediksi, pada umumnya dapat ditangani dan bersifat reversibel. Dari penelitian-penelitian yang ada hingga kini, kejadian tidak diinginkan terkait obat (KTD) sebagian besar berhubungan dengan gangguan saluran pencernaan (diare) dan gangguan kulit (ruam), yang sejalan dengan sistem kerja penghambatan tirosin kinase EGFR.1-4 Untuk keterangan lebih lanjut, silakan merujuk pada informasi produk.
Referensi:
1. Informasi Produk GIOTRIF®
2. Sequist L et al. J Clin Oncol 2013;31(27)3327–34.
3. Wu YL et al. Lancet Oncol 2014;15(2):213–22.
4. Park K et al. Lancet Oncol 2016;17(5):577–89.
Efek samping dari Afatinib dapat terprediksi, pada umumnya dapat ditangani dan bersifat reversibel. Dari penelitian-penelitian yang ada hingga kini, kejadian tidak diinginkan terkait obat (KTD) sebagian besar berhubungan dengan gangguan saluran pencernaan (diare) dan gangguan kulit (ruam), yang sejalan dengan sistem kerja penghambatan tirosin kinase EGFR.1-4 Untuk keterangan lebih lanjut, silakan merujuk pada informasi produk.
Referensi:
1. Informasi Produk GIOTRIF®
2. Sequist L et al. J Clin Oncol 2013;31(27)3327–34.
3. Wu YL et al. Lancet Oncol 2014;15(2):213–22.
4. Park K et al. Lancet Oncol 2016;17(5):577–89.